CO2
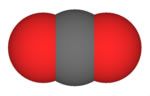
O dióxido de carbono é constituído estruturalmente por moléculas de geometria linear e de caráter apolar. Por isso as atrações intermoleculares são muito fracas, tornando-o, nas condições ambientais, um gás. Daí o seu nome comercial gás carbônico.
Anidrido carbônico ou gás carbônico é um composto químico constituído por dois átomos de oxigênio e um átomo de carbono. A representação química é CO2. O dióxido de carbono foi descoberto pelo escocês Joseph Black em 1754.

Laser de dióxido de carbono
O carbono é um elemento básico na composição dos organismos, tornando-o indispensável para a vida no planeta. Este elemento é estocado na atmosfera, nos oceanos, solos, rochas sedimentares e está presente nos combustíveis fósseis (petróleo, carvão mineral e gás natural). Contudo, o carbono não fica fixo em nenhum desses estoques. Existe uma série de interações por meio das quais ocorre a transferência de carbono de um estoque para outro (fluxos). Muitos organismos nos ecossistemas terrestres e nos oceanos, como as plantas, absorvem o carbono encontrado na atmosfera na forma de dióxido de carbono (CO2). Esta absorção se dá através do processo de fotossíntese. Por outro lado, os vários organismos, tanto plantas como animais, liberam dióxido de carbono para a atmosfera mediante o processo de respiração. Existe ainda o intercâmbio de dióxido de carbono entre os oceanos e a atmosfera por meio da difusão.
O dióxido de carbono é essencial à vida no planeta. Visto que é um dos compostos essenciais para a realização da fotossíntese – processo pelo qual os organismos fotossintetizantes transformam a energia solar em energia química. Esta energia química, por sua vez é distribuída para todos os seres vivos por meio da teia alimentar. Este processo é uma das fases do ciclo do carbono e é vital para a manutenção dos seres vivos.
Nas últimas décadas, devido à enorme queima de combustíveis fósseis, a quantidade de gás carbônico na atmosfera tem aumentado muito, contribuindo para o aquecimento do planeta.
A liberação de dióxido de carbono via queima de combustíveis fósseis e mudanças no uso da terra (desmatamentos e queimadas, principalmente) impostas pelo homem constituem importantes alterações nos estoques naturais de carbono e tem um papel fundamental na mudança do clima do planeta. Isto porque – depois do vapor d água – o CO2 é o gás do efeito estufa que mais contribui para o aquecimento global.
O excesso de dióxido de carbono que atualmente é lançado para a atmosfera resulta da queima de combustíveis fósseis principalmente pelo setor industrial e de transporte. Além disso, reservatórios naturais de carbono e os sumidouros (ecossistemas com a capacidade de absorver CO2) também estão sendo afetados por ações antrópicas. No caso das florestas, um estoque natural de carbono, o desmatamento e as queimadas estão contribuindo para o aumento do efeito estufa, uma vez que liberam principalmente CO2 para a atmosfera. O desmatamento e o uso da terra contribui com aproximadamente 1 (MACKENZIE,1995) a 2 Pg C ano-1 (HOUGTON et al.1987). Devido o solo possuir um estoque 2 a 3 vezes maior que a atmosfera, mudanças no suo do solo podem ser importante fonte de carbono para a atmosfera (WOODWEL,1989,DAVIDSON e TRUMBORE, 1995).
A concentração de CO2 na atmosfera começou a aumentar no final do século XVIII, quando ocorreu a revolução industrial, a qual demandou a utilização de grandes quantidades de carvão mineral e petróleo como fontes de energia. Desde então, a concentração de CO2 passou de 280 ppm (partes por milhão) no ano de 1750, para os 368 ppm atuais, representando um incremento de aproximadamente 30%. Este acréscimo na concentração de CO2 implica no aumento da capacidade da atmosfera em reter calor e, conseqüentemente, da temperatura do planeta. As emissões de CO2 continuam a crescer e, provavelmente, a concentração deste gás poder alcançar 550 ppm por volta do ano 2100.
Riscos
Aplicações
- O CO2 é utilizado em bebidas (bebidas carbonatadas) para dar-lhes efervescência.
- É utilizado em extintores durante os incêndios para isolar o oxigênio do combustível.
- É utilizado em butijas para a prática de Paintball.
| Modelo espacial e fórmula estrutural | |
|---|---|
 |
|
| Nomes comuns | Anidrido carbônico Gás carbônico Gelo seco (quando em estado sólido) |
| Nome IUPAC | Dióxido de carbono |
| Aparência | gás incolor |
| Fórmula química | CO2 |
| Número CAS | 124-38-9 |
| Características físicas | |
| Solubilidade | 0,145 g/100ml de água |
| Densidade | 1,6 ×103 kg/m3 (sólido) 1,98 kg/m3 (gás a 298 K) |
| Massa molecular | 44,0 um |
| Ponto de fusão | 216 K (-57 °C) (pressurizado) |
| Ponto de ebulição | sublima a 195 K (-78 °C) |
| Termoquímica | |
| S0gás | 213,79 J·mol-1·K-1 |
| S0sólido | ? J·mol-1·K-1 |
| ΔfH0gas | -393,52 kJ/mol |
| ΔfH0sólido | ? kJ/mol |
| Informações sobre segurança | |
| Olhos | Pode levar a cegueira. |
| Pele | Gelo seco pode ocasionar ulcerações. |
| Ingestão | Pode causar náusea, vômitos, hemorragia gastrointestinal. |
| Inalação | Asfixia (sufocamento), causa hiperventilação. |
| Frases de Risco e Segurança | R: – S:9, 23 |
| Unidades do SI são usadas quando possível. Salvo quando especificado o contrário, são considerados condições normais de temperatura e pressão. | |

