Oxigênio

Aparelho de uso doméstico para concentração de oxigênio, utilizado no tratamento de pacientes com enfisema. O modelo mostrado na foto é o DeVILBISS LT 4000.
O oxigênio representa aproximadamente 20% da composição da atmosfera terrestre. É um elemento químico de símbolo O, número atômico 8 (8 prótons e 8 elétrons) com massa atômica 16 u.
É essencial na química orgânica, participando de maneira relevante no ciclo energético dos seres vivos, sendo essencial na respiração celular dos organismos aeróbicos. Um átomo de oxigênio combinado com dois de hidrogênio forma uma molécula de água.
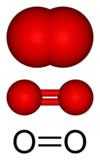
Na sua forma molecular, O2, é um gás a temperatura ambiente, incolor, insípido, inodoro, comburente, mas não combustível e pouco solúvel em água.
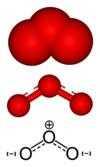
Existe, também, uma forma molecular formada por três átomos de oxigênio, O3, denominada ozônio, cuja presença na atmosfera protege a Terra da incidência de radiação ultravioleta procedente do Sol.
| Estrutura Molecular | ||
|---|---|---|
 |
 |
|
| O oxigênio diatômico (O2) é um gás em condições padrão. | O ozônio (O3) é um gás raro, encontrado principalmente na estratosfera. | |
Características principais
Nas condições normais de pressão e temperatura o oxigênio se encontra no estado gasoso formando moléculas diatômicas de formula O2. É formado durante a fotossíntese das plantas e, posteriormente utilizado pelos animais na respiração. O oxigênio líquido e sólido tem uma ligeira coloração azulada e,em ambos os estados, é muito paramagnético. O oxigênio líquido se obtém usualmente a partir da destilação fracionada do ar líquido, junto com o nitrogênio. Reage praticamente com a totalidade dos metais, exceto com os metais nobres como ouro, platina e outros, provocando a corrosão. É incolor. O oxigênio tem três isótopos estáveis e dez radioativos. Todos os radioisótopos do oxigênio tem uma meia-vida de menos de três minutos.
Compostos
Sua alta eletronegatividade o faz reagir com quase qualquer elemento químico excetuando alguns poucos gases nobres.
O composto mais notável do oxigênio é a água (H2O). Outros compostos importantes de oxigênio também são bem conhecidos como o dióxido de carbono, os alcoóis (R-OH), aldeídos, (R-CHO), e ácidos carboxílicos (R-COOH).
Os radicais clorato (ClO3–), perclorato (ClO4–), cromato (CrO42-), dicromato (Cr2O72-), permanganato (MnO4–) e nitrato (NO3–) são fortes agentes oxidantes. Os Epóxidos são éteres na qual o átomo de oxigênio é um hétero-tomo.
O Ozônio (O3) se forma mediante descargas elétricas a partir do oxigênio molecular (durante as tormentas elétricas, por exemplo).
No oxigênio líquido já foi encontrado, em pequenas quantidades, uma dupla molécula de oxigênio: (O2)2.
| Características principais | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome | Oxigênio | ||||||||||||||||||||||||
| Símbolo | O | ||||||||||||||||||||||||
| Número Atômico | 8 | ||||||||||||||||||||||||
| Classe | Não-metal | ||||||||||||||||||||||||
| Série Química | Representativo (Calcogênico) | ||||||||||||||||||||||||
| Grupo | 16 (VIA) | ||||||||||||||||||||||||
| Período | 2 | ||||||||||||||||||||||||
| Bloco | P | ||||||||||||||||||||||||
| Densidade | 1,429 km/m³ (273K) | ||||||||||||||||||||||||
| Dureza | (ND) | ||||||||||||||||||||||||
| Aparência e Cor | Incolor |
||||||||||||||||||||||||
| Propriedades Atômicas | |||||||||||||||||||||||||
| Massa Atômica | 15,994(3) u | ||||||||||||||||||||||||
| Configuração Eletrônica | [He]2s22p4 | ||||||||||||||||||||||||
| Estado de Oxidação (Óxido) | -2, -1 (neutro) | ||||||||||||||||||||||||
| Raio Atômico (Calculado) | 60 (48) pm | ||||||||||||||||||||||||
| Raio Covalente | 73 pm | ||||||||||||||||||||||||
| Raio de van der Waals | 152 pm | ||||||||||||||||||||||||
| Elétrons por nível de energia | 2, 6 | ||||||||||||||||||||||||
| Estrutura Cristalina | Cúbica | ||||||||||||||||||||||||
| Propriedades Físicas | |||||||||||||||||||||||||
| Ponto de Fusão | 50,35 K (-222,8 °C) | ||||||||||||||||||||||||
| Ponto de Ebulição | 90,18 K (-182,97 °C) | ||||||||||||||||||||||||
| Volume Molar | 17,36 × 10-6 m3/mol | ||||||||||||||||||||||||
| Pressão de Vapor | Indefinida | ||||||||||||||||||||||||
| Velocidade do Som | 317,5 m/s (293 K) | ||||||||||||||||||||||||
| Entalpia de Vaporização | 3,4099 kJ/mol | ||||||||||||||||||||||||
| Entalpia de Fusão | 0,22259 kJ/mol | ||||||||||||||||||||||||
| Estado da Matéria | Gás (paramagnético) | ||||||||||||||||||||||||
| Características Diversas | |||||||||||||||||||||||||
| 1º Potencial de Ionização | 1313,9 kJ/mol | ||||||||||||||||||||||||
| 2º Potencial de Ionização | 3388,3 kJ/mol | ||||||||||||||||||||||||
| 3º Potencial de Ionização | 5300,5 kJ/mol | ||||||||||||||||||||||||
| 4º Potencial de Ionização | 7469,2 kJ/mol | ||||||||||||||||||||||||
| Condutividade Elétrica | Indefinida | ||||||||||||||||||||||||
| Condutividade Térmica | 0,02674 W/m*K | ||||||||||||||||||||||||
| Eletronegatividade | 3,44 (Escala de Pauling) | ||||||||||||||||||||||||
| Calor Específico | 920 J/kg*K | ||||||||||||||||||||||||
| Isótopos Mais Estáveis | |||||||||||||||||||||||||
|
|||||||||||||||||||||||||
| Unidades SI e CNPT, exceto onde indicado o contrário | |||||||||||||||||||||||||
Oxigênio e sua História
O elemento oxigênio foi descoberto pelo farmacêutico sueco Carl Wilhelm Scheele em 1771, porém o seu trabalho não obteve reconhecimento imediato. Muitos atribuem a Joseph Priestley o seu descobrimento, que ocorreu independentemente em 1 de agosto de 1774.
O nome oxigênio foi dado por Lavoisier em 1774 após ter observado que existiam muitos ácidos que continham oxigênio.
| Pais do Oxigênio | ||
|---|---|---|
 |
 |
 |
| Joseph Priestley é aceito pela maioria como descobridor do oxigênio. | Carl Wilhelm Scheele descobriu o oxigênio antes de Priestley, mas como publicou sua descoberta anos mais tarde, perdeu os créditos. | Antoine Lavoisier, responsável pelo nome do elemento. |
Abundância e Obtenção
É o elemento mais abundante da crosta terrestre (estimado em 46,7%) e, dos oceanos (em torno de 87% como componente da água). É o segundo em abundância na atmosfera (cerca de 20%). Os óxidos de metais, silicatos (SiO44-) e carbonatos (CO32-) são encontrados com freqüência em rochas e no solo. Na atmosfera existe como oxigênio molecular, O2, dióxido de carbono (CO2) e, em menor proporção como monóxido de carbono (CO), ozônio (O3), dióxido de nitrogênio (NO2), monóxido de nitrogênio (NO), dióxido de enxofre (SO2) e outros.
Nos planetas exteriores mais afastados do Sol e em cometas se encontra água congelada e outros compostos de oxigênio. Por exemplo, no planeta Marte há dióxido de carbono congelado. O espectro deste elemento também foi detectado em algumas poucas estrelas.
A obtenção é feita a partir da destilação fracionada por baixa temperatura do ar atmosférico (criogenia). No mesmo processo são obtidos o nitrogênio e o argônio.
Ação Biológica
O oxigênio respirado pelos organismos aeróbicos, liberado pelas plantas no processo de fotossíntese, participa na conversão de nutrientes em energia intracelular.
A redução do nível de oxigênio provoca a hipoxemia e, a falta total ocasiona a anoxia, podendo provocar a morte do organismo.
A hemoglobina é o pigmento que dá a cor aos glóbulos vermelhos (eritrócitos) e tem a função vital de distribuir o oxigênio pelo organismo.
Precauções
O oxigênio pode ser tóxico a elevadas pressões parciais.
Alguns compostos de oxigênio como o ozônio, o peróxido de hidrogênio e radicais hidroxila são muito tóxicos. O corpo humano desenvolveu mecanismos de proteção contra estas espécies tóxicas. Por exemplo, a glutación atua como antioxidante, como a bilirrubina que é um produto derivado do metabolismo da hemoglobina.
As atmosferas ricas em oxigênio, em presença de materiais combustíveis, são suscetíveis de provocar incêndios que se propagam com grande rapidez, podendo provocar explosões. Do mesmo modo, pode ocorrer quando existem fontes de oxigênio como cloratos, percloratos, dicromatos e outros. Estes compostos com alto poder oxidante podem, também, provocar queimaduras químicas.
Aplicações
A principal utilização do oxigênio é como oxidante devido a sua elevada eletronegatividade, superada somente pela do flúor. Por isso, o oxigênio líquido é usado como comburente nos motores de propulsão dos foguetes, apesar de que nos processos industriais o oxigênio para a combustão é obtido diretamente do ar.
Outras aplicações industriais são na soldadura e na fabricação de aço e metanol.
A medicina usa o oxigênio administrando-o como suplemento em pacientes com dificuldades respiratórias.
Também é engarrafado para ser respirado em diversas práticas desportivas como, por exemplo, o submarinismo ou em atividades profissionais para acessar a locais de pouca ou nenhuma ventilação ou em atmosferas contaminadas. O oxigênio provoca uma resposta de euforia quando inalado. No século XIX era utilizado misturado com o óxido nitroso como analgésico.
Atualmente, esta mistura ressurgiu para evitar a dor em tratamentos dentários. O Oxigênio-15, radioativo com emissão de pósitron é usado no exame PET do cérebro em medicina nuclear.

